Quanto mais se estuda a forma de padronização e de disponibilização da assistência terapêutica do SUS, mais se percebe a complexidade do regramento jurídico a elas relacionado e de sua operacionalização. Não por outro motivo, aliás, este é o terceiro capítulo da série “Decifra-me ou te devoro”, que já tratou, anteriormente, da pactuação da assistência farmacêutica e da divisão de competências nas ações e serviços públicos em saúde.
Agora, o que se pretende entender é como e por que medicamentos oncológicos são incorporados ao SUS. Essa compreensão é de suma importância para o operador do Direito à Saúde saber lidar com algumas das causas da judicialização relacionada ao tratamento do câncer.
Diante do que se tem visto ultimamente na prática, a missão não será fácil.
Antes de tudo, é preciso deixar bem assentada a forma como a assistência oncológica, especialmente a medicamentosa, é prestada pelo SUS.
O fornecimento dos fármacos para o tratamento do câncer deverá ocorrer, preferencialmente, por intermédio da Unidade de Assistência de Alta Complexidade (UNACON) ou do Centro de Assistência de Alta Complexidade em Oncologia (CACON) no qual o paciente já vem sendo tratado, conforme diretriz traçada pela Portaria nº 874/2013 do Ministério da Saúde. O art. 25, III, da Portaria dispõe que os hospitais especializados habilitados para a assistência oncológica são responsáveis pelos serviços relacionados ao tratamento do câncer e à atenção às urgências referentes às intercorrências e agudização da doença.
Via de regra, não há uma lista de medicamentos oncológicos disponíveis no SUS. Cabe aos CACON’s ou UNACON’s definirem, dentro das Diretrizes Diagnósticas e Terapêuticas estabelecidas pelo Ministério da Saúde, aqueles que serão fornecidos aos seus pacientes com o posterior reembolso, pela União, por meio das respectivas Autorizações de Procedimentos de Alta Complexidade – APAC. Assim, os hospitais são responsáveis pela aquisição e fornecimento dos medicamentos por eles mesmos padronizados, cabendo-lhes codificar e cobrar conforme as normas expressas nas portarias e manuais do SUS.
A liberdade de definição e prescrição dos medicamentos pelos CACON’s/UNACON’s, portanto, é limitada pelo valor da APAC. Se o tratamento disponibilizado pela instituição de saúde tiver um custo maior, ela precisará arcar com as despesas excedentes por sua conta. Sendo assim, dentro do atual modelo de assistência oncológica, não haveria, em um primeiro momento, necessidade de incorporação de fármacos à Relação Nacional de Medicamentos (RENAME), como ocorre com as demais doenças. O que se torna necessária é a estipulação de valores de APAC’s que sejam condizentes com os tratamentos adequados a serem disponibilizados pelo SUS dentro da margem de liberdade conferida às instituições de saúde credenciadas.
Nada impede, entretanto, que o Ministério da Saúde opte por padronizar determinados medicamentos oncológicos para facilitar a logística de sua dispensação ou por razões de ordem financeira, quando a aquisição centralizada se mostrar mais vantajosa. Foi o que ocorreu com as seguintes drogas: mesilato de imatinibe, dasatinibe, nilotinibe, trastuzumabe, l-asparaginase, rituximabe e dactinomicina. Todas elas são adquiridas diretamente pelo Ministério da Saúde, enviadas às Secretarias Estaduais de Saúde e então distribuídas aos CACON´s/UNACON’s.
Desta forma, não há, ordinariamente, necessidade de avaliação de medicamentos oncológicos pela CONITEC para que eles possam ser dispensados pelo SUS.
A despeito disso, têm sido bastante comuns as submissões de remédios para o tratamento de câncer à análise da CONITEC com a consequente emissão de relatórios de recomendação. Sendo positivo o parecer da agência, tais medicamentos acabam sendo efetivamente padronizados pelo Ministério da Saúde, a despeito da regra geral de se conferir ampla liberdade aos CACON’s/UNACON’s para a definição das drogas a serem ministradas aos pacientes, com posterior ressarcimento das despesas nos limites das APAC’s.
O problema é que grande parcela dos medicamentos oncológicos incorporados não está sendo efetivamente disponibilizada, mesmo vários anos após a incorporação.
A seguinte relação – gentilmente disponibilizada pela Secretaria de Saúde do Paraná – elenca uma série de medicamentos para o tratamento de câncer que já foram incorporados pelo Ministério da Saúde, mas não estão sendo adquiridos e fornecidos até o momento, mesmo ultrapassado o prazo máximo para disponibilização de cento e oitenta dias após a incorporação (art. 25 do Decreto 7.646/2011):
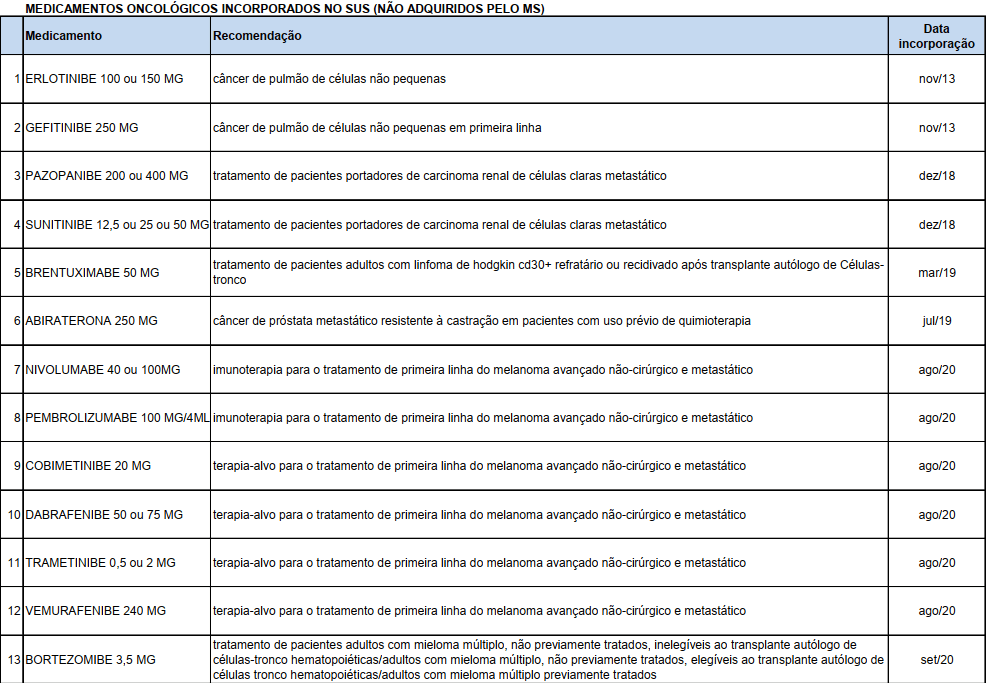
Considerando o grande número de fármacos presentes na lista e também que alguns desses medicamentos já foram incorporados ao SUS há mais de sete anos, é difícil crer que a não disponibilização aos pacientes decorra de trâmites burocráticos ou de dificuldades na aquisição. De qualquer forma, se realmente há empecilhos insuperáveis para o fornecimento (a falta de aquisição vários anos após a incorporação não deve decorrer de problemas provisórios e contornáveis), é preciso que sejam claramente expostos. Neste caso, cabe ao Ministério da Saúde revogar a incorporação de maneira fundamentada. Se os empecilhos não existem, então as respectivas portarias de incorporação devem ser cumpridas com a efetiva aquisição e entrega dos medicamentos.
Argumentos de ordem financeira não seriam justificativas válidas para a não disponibilização de medicamentos oncológicos já incorporados ao SUS. Ocorre que a CONITEC analisa a relação custo-efetividade dos medicamentos submetidos ao seu crivo, além de estimar o impacto orçamentário aos cofres públicos para os anos seguintes. Como a incorporação ocorre necessariamente após o relatório da CONITEC, é de se pressupor que o gestor tem conhecimento e garante a existência dos recursos necessários para a aquisição e disponibilização dos fármacos. Caso contrário, a incorporação não teria ocorrido – ou, ao menos, não deveria tê-lo.
De qualquer forma, ainda que se considere que a incorporação foi irregular, impossível de ser bancada ou inconveniente ao interesse público por não haver recursos financeiros suficientes para arcar com as despesas dela decorrentes, a portaria que a determinou deve ser anulada ou revogada. O que não se pode admitir é um ato administrativo válido e em plena vigência que simplesmente não é cumprido pela própria Administração.
Outro problema que tem sido recorrente nas incorporações de medicamentos oncológicos é o condicionamento da efetiva disponibilização à negociação de preço com o fabricante. O que acontece é que, em regra, tanto os relatórios da CONITEC como as subsequentes portarias de incorporação simplesmente estabelecem tal requisito, mas sem prever as consequências para a sua não implementação no prazo legal. Além disso, não se levam a público os resultados da negociação de preço ou mesmo o início e a finalização das tratativas.
A negociação de preço de um medicamento incorporado ao SUS não é apenas uma condição para a sua disponibilização, quando assim prevista na respectiva portaria. Ela é também uma obrigação do Ministério da Saúde. Se não existe intenção de negociar, e sendo esse um requisito constante no relatório de recomendação da CONITEC, ou a portaria de incorporação deve afastá-lo para que a padronização seja incondicional, ou não deve haver incorporação. No entanto, se a opção discricionária do gestor foi a de incorporar o medicamento mediante negociação de preço, então as tratativas devem ser feitas, mesmo que não sejam ao final exitosas.
O art. 25 do Decreto nº 7.646/2011 dispõe que “a partir da publicação da decisão de incorporar tecnologia em saúde, ou protocolo clínico e diretriz terapêutica, as áreas técnicas terão prazo máximo de cento e oitenta dias para efetivar a oferta ao SUS”.
Desta forma, se o Ministério da Saúde não demonstrar ao menos que deu início à negociação de preços dentro do prazo de cento e oitenta dias, mas também não revogar a portaria de incorporação, o medicamento incorporado deve ser imediatamente concedido, inclusive por determinação judicial, se for o caso.
Situação mais complexa ocorre quando as tratativas entre a Administração e o fabricante, apesar de iniciadas, não foram finalizadas dentro do prazo de cento e oitenta dias. Neste caso, a rigor, seria necessário analisar se a delonga foi indevidamente causada por uma das partes, o que é bastante difícil. Ainda assim, é de se exigir ao menos que o Ministério da Saúde explique que não foi possível a finalização da negociação e prorrogue o prazo para a disponibilização do medicamento por meio de Decreto do Poder Executivo (diploma de igual hierarquia ao que estabeleceu o prazo de cento e oitenta dias), ou então que revogue a portaria de incorporação. O importante, acima de tudo, é que se saiba a quantas anda a negociação.
Para não desanimar aqueles que pretendem compreender de forma clara as nuances da política de assistência oncológica medicamentosa no SUS, trago um último problema.
Como visto anteriormente, a regra é a da inexistência de padronização dos medicamentos oncológicos disponíveis no SUS, já que as instituições de saúde que oferecem tratamento do câncer possuem liberdade para definirem os respectivos esquemas terapêuticos, mediante posterior reembolso das despesas pelo Ministério da Saúde via APAC. Sendo assim, a disponibilização de medicamentos novos pode dispensar qualquer providência do gestor público, desde que a oferta seja compatível com o valor da APAC. Se não for, ela deve ser feita mediante o aumento da APAC ou pela aquisição centralizada do próprio fármaco.
Neste cenário, seria bastante interessante que a CONITEC, ao fazer a análise da relação custo-efetividade do medicamento oncológico submetido à sua apreciação e do impacto orçamentário decorrente de sua incorporação, também examinasse a necessidade ou conveniência de sua oferta mediante inserção na RENAME, por meio de incremento do valor da APAC ou mesmo sem que seja necessária qualquer providência adicional, caso os recursos da APAC já sejam suficientes para a dispensação.
Foi isso o que a CONITEC fez no relatório de recomendação do sorafenibe para tratamento do carcinoma hepatocelular, ocasião em que concluiu não haver necessidade de incorporação pelo fato de o medicamento ser suportado pela APAC (não vamos, neste momento, entrar no mérito do acerto desta conclusão). Vejamos:
“O plenário da CONITEC esclareceu a dinâmica do tratamento oncológico, onde o procedimento APAC de tratamento do carcinoma hepatocelular não inviabiliza o uso do medicamento sorafenibe por pacientes no âmbito do SUS. O esquema de tratamento deve ser definido pelo médico em conjunto com o paciente, conforme protocolo do serviço de saúde assistencial. O valor de reembolso será o valor proposto para as APACs disponíveis para o tratamento do CHC avançado irressecável. Não há a necessidade de criação de um novo procedimento APAC específico para a incorporação do sorafenibe nos esquemas quimioterápicos utilizados no SUS para o tratamento do CHC avançado irressecável em monoterapia na quimioterapia paliativa”.
Com base nisso, a recomendação foi de sua não incorporação ao SUS.
Infelizmente, entretanto, nem sempre as coisas são tão claras.
Em vários relatórios de avaliação de medicamentos oncológicos, a CONITEC não fez qualquer consideração específica acerca da necessidade ou conveniência de efetiva incorporação do medicamento para aquisição centralizada ao invés de sua dispensação direta pelos CACON’s/UNACON’s e posterior reembolso via APAC, ou vice-versa. Foi o que ocorreu, por exemplo, com o trastuzumabe, o nivolumabe e a abiraterona, todos com recomendação favorável à incorporação para inclusão na RENAME.
No caso do pazopanibe e do sunitinibe para tratamento do carcinoma de células renais metastático, a situação ficou obscura. Apesar de concluir que o valor da APAC é insuficiente para o custeio dos medicamentos, a CONITEC recomendou a sua incorporação “conforme o modelo da assistência oncológica no SUS”:
“Nesse contexto a CONITEC reconheceu que o valor ressarcido pelo procedimento APAC é insuficiente para a utilização de medicamentos como sunitinibe e pazopanibe, para o tratamento do carcinoma de células renais metastático pelos hospitais credenciados no SUS e habilitados em oncologia”. (...) “Os membros da CONITEC presentes na 72ª reunião ordinária, nos dias 07 e 08 de novembro de 2018, deliberaram, por unanimidade, por recomendar a incorporação do cloridrato de pazopanibe e do malato de sunitinibe para carcinoma renal de células claras metastático, mediante negociação de preço e conforme o modelo da Assistência Oncológica no SUS”.
Ocorre que o modelo da assistência oncológica do SUS é justamente o de livre aquisição pelos hospitais com posterior ressarcimento por APAC, cujo valor, no caso concreto, a CONITEC reputou insuficiente para as despesas com os fármacos. Presume-se que a incorporação seja feita mediante padronização e inclusão dos remédios na RENAME, mas neste caso não se estará seguindo o “modelo de assistência oncológica”. Se for para seguir o modelo, haverá necessidade de aumento do valor da APAC. O fato é que, até o momento, nem uma coisa nem outra foi feita.
A incorporação do gefitinibe para câncer de pulmão de células não pequenas em primeira linha também foi um tanto confusa. Acontece que, ao avaliar o impacto orçamentário da incorporação, a CONITEC fez constar o seguinte em seu relatório de recomendação:
“Impacto orçamentário de R$ 8,3 milhões no primeiro ano e R$ 42,2 milhões em 5 anos. Considerando, porém, a incorporação sem modificação do modelo de financiamento, no mesmo valor da APAC para tratamento quimioterápico do câncer de pulmão células não pequenas avançado atual, não haveria impacto orçamentário para o sistema”.
Se o valor do medicamento já “cabe” na APAC, não haveria, em um primeiro momento, necessidade de sua incorporação. Se houve razões que serviram para justificá-la, não foram expostas de forma clara no relatório.
Como se pode perceber, não há um alinhamento visível entre o modelo da assistência oncológica no SUS e a forma pela qual a incorporação dos medicamentos para o tratamento do câncer vem sendo conduzida pela CONITEC. O próprio órgão, aliás, parece já ter se dado conta da necessidade de examinar de maneira mais detida esses tipos de drogas. É o que se constata na leitura da Ata de sua 72ª Reunião, que tratou da incorporação do pazopanibe e do sunitinibe. Após diversas manifestações na consulta pública sobre as dificuldades encontradas no modelo de assistência oncológica e sobre a corriqueira insuficiência dos valores das APAC’s para a adequada cobertura dos tratamentos necessários, a ata registra que:
“(...) o plenário concordou que algumas informações deveriam ser melhor apresentadas no relatório e alguns membros retomaram a questão de como a CONITEC deve avaliar e incorporar medicamentos antineoplásicos, visto o modelo de assistência oncológica do SUS. Porém, foi orientado que a CONITEC deve manifestar sua recomendação de incorporação ou não, e como o medicamento será disponibilizado será definido posteriormente, de acordo com o financiamento adequado”.
O ideal é que a CONITEC avalie expressamente se no caso concreto é necessário ou conveniente que o fornecimento de medicamento oncológico submetido à sua análise se dê mediante aquisição centralizada pelo Ministério da Saúde ou pelo modelo de assistência oncológica do SUS (via APAC). Isso seria feito no contexto do estudo do impacto orçamentário. Na segunda hipótese, é preciso avaliar também se o valor da APAC para o tratamento do tipo de câncer investigado é suficiente para cobrir as despesas com o novo fármaco. Se a conclusão for positiva e não houver vantagens claras na aquisição centralizada, não há necessidade de incorporação. Por outro lado, se o valor da APAC for insuficiente, seria de suma relevância que a CONITEC fizesse constar essa informação em seu relatório, caso não se opte pela padronização do medicamento.
Esse panorama tão confuso tem dado causa a grande parte da judicialização da saúde relacionada aos medicamentos oncológicos, que poderia, entretanto, ser evitada. Para isso, é preciso que:
a) o Ministério da Saúde dê efetivo cumprimento às portarias de incorporação dessas drogas, adquirindo-as e as disponibilizando segundo os critérios de incorporação;
b) o Ministério da Saúde haja de forma clara e transparente na negociação de preços com o fabricante após a incorporação sempre que ela for uma condição para a disponibilização do medicamento; bem como que decida objetivamente pela manutenção ou revogação das incorporações em que o acordo não for obtido;
c) a CONITEC aprofunde a análise do impacto orçamentário das incorporações de medicamentos oncológicos considerando dois cenários: i) a padronização do medicamento com sua inclusão na RENAME; e ii) o seu custeio segundo o modelo de assistência oncológica, ou seja, mediante livre aquisição pelos CACON’s/UNACON’s e posterior ressarcimento via APAC. Nesta segunda hipótese, é preciso que se deixe claro se o valor da APAC é realmente suficiente para arcar com os gastos do remédio.
Imagem do Post: Paul Hanaoka on Unsplash





